El Uso de la Temperatura Cinética Media y la Necesidad de Límites de Excursiones Permitidas para la Zona Climática IVb
Glaucia K. Bragaa,b, Luciana S. Takarac, Chris J. Andersona,d, Robert H. Seeversaa,e, Søren Kåre Nielsenaa,f, Desmond G. Huntc
La correspondencia debe dirigirse a: Desmond G. Hunt, Científico Principal Sénior, US Pharmacopeia, 12601 Twinbrook Parkway, Rockville, MD 20852-1790; correo electrónico: dgh@usp.org.
ESTÍMULOS AL PROCESO DE REVISIÓN
Los artículos de Estímulos no reflejan necesariamente las políticas del Consejo de Expertos de la USP
RESUMEN
Hay una preocupación creciente respecto al almacenamiento y transporte apropiados de los medicamentos terminados ya que el hacerlo fuera de las especificaciones pertinentes puede impactar la calidad, la eficacia y la seguridad de los medicamentos. Sin embargo, aunque debe hacerse todo lo posible para mantener al medicamento dentro del intervalo de temperaturas indicado en el envase, a veces pueden ocurrir excursiones (desviaciones) de temperatura. Una vez que ocurran, deberá evaluarse su impacto. La temperatura cinética media (TCM) es una temperatura única calculada, en la que la cantidad total de degradación durante un periodo determinado es igual a la suma de las degradaciones individuales que ocurrirían a diversas temperaturas. Sin embargo, la TCM por sí sola no es suficiente para evaluar el impacto de una excursión de temperatura. Además de la TCM es necesario saber lo siguiente: el tiempo de la excursión de la temperatura, la temperatura real de la(s) excursión(es), si hubo una excursión de temperatura superior a 40°, y el periodo de tiempo usado para calcular la TCM. Los límites de excursiones permitidos son esenciales para responder a las incógnitas anteriores y evaluar la gravedad de las excursiones con un enfoque basado en el riesgo. Los límites de las excursiones de la TCM contenidos en el capítulo Temperatura Cinética Media en la Evaluación de las Excursiones de Temperatura durante el Transporte y Almacenamiento de Medicamentos ?1079.2?, son específicos para los productos almacenados a temperatura ambiente controlada (20°–25°) y a temperatura fría controlada (2°–8°). En su redacción actual, el capítulo no toma en cuenta el almacenamiento del producto entre 15° y 30°, que generalmente es el intervalo de almacenamiento y transporte de los medicamentos en los países de la zona climática IVb.
En este momento es especialmente importante establecer límites de excursiones de temperatura permitidos para la zona climática IVb, no solo para evaluar el impacto de una excursión en el producto durante su distribución, sino también para establecer un criterio de aceptación para los estudios de caracterización de perfiles de temperatura de los recorridos (mapeo de la temperatura de los recorridos). El establecimiento de límites de excursiones de la TCM para el almacenamiento y transporte de medicamentos en zonas climáticas IVb será un recurso importante a nivel mundial, por lo que el objetivo de este artículo de Estímulo es presentar el caso para actualizar el capítulo ?1079.2? para abordar la TCM para la zona climática IVb.
INTRODUCCIÓN
En marzo del 2022, la Farmacopea de los Estados Unidos (USP) en Latinoamérica (LATAM), en colaboración con dos grupos de interés importantes brasileños: Sindusfarma (Sindicato de la Industria de Productos Farmacéuticos) y la Academia de Ciencias Farmacéuticas de Brasil, organizaron un taller sobre las buenas prácticas de distribución (GDP, por sus siglas en inglés) de medicamentos terminados. Este evento brindó la oportunidad de compartir aún más información sobre los recursos de la USP relacionados con las buenas prácticas de distribución, incluidos los capítulos generales Riesgos y Estrategias de Mitigación para el Almacenamiento y Transporte de Medicamentos Terminados ?1079? y Temperatura Cinética Media en la Evaluación de las Excursiones de Temperatura Durante el Transporte y Almacenamiento de Medicamentos ?1079.2?. El programa también incluyó presentaciones sobre el marco normativo de las Buenas Prácticas de Distribución en Brasil (ANVISA Resolución, RDC No. 430/2020), la utilización de la temperatura cinética media (TCM) para evaluar las excursiones de temperatura en distintas regiones de Brasil y la metodología y los resultados de un estudio piloto de calificación de un recorrido, realizado para cumplir con la reglamentación de las buenas prácticas de distribución de ANVISA.
Asistieron al taller más de 800 participantes, incluyendo autoridades reguladoras, cámaras de comercio brasileñas (fabricantes, distribuidores y transportistas de medicamentos) así como profesionales en asuntos reglamentarios. Durante la sesión de preguntas y respuestas, el animado debate dio lugar a una serie de preguntas profundas, así como a la identificación, por parte de USP LATAM, de brechas en el conocimiento de la TCM por parte de Brasil y en la norma de la TCM de la USP. Algunas de las discrepancias identificadas incluyen como se manejan las excursiones de temperatura en Brasil, la confusión en el uso de la TCM, el uso de los límites de excursiones de la TCM de la USP durante el almacenamiento y transporte de medicamentos en la zona climática IVb, y la posibilidad de actualizar la norma de la TCM de USP para incluir el almacenamiento y transporte de medicamentos en la zona climática IVb.
En los capítulos generales Requisitos de Envasado y Almacenamiento ?659? y ?1079.2?, los límites de excursiones de la TCM son específicos para los productos almacenados a temperatura ambiente controlada (CRT, por sus siglas en inglés, 20°–25°) y a temperatura fría controlada (2°–8°). En su redacción actual, los capítulos no toman en cuenta el almacenamiento del producto entre 15° y 30°, que generalmente es el intervalo de almacenamiento y transporte de los medicamentos en los países de la zona climática IVb.
De manera paralela, una investigación interna realizada por la USP identificó que el tema de las excursiones de temperatura y la zona climática IVb es un área donde sería necesario contar con mayor orientación por parte de la USP, además de apoyar al Comité de Expertos de Envasado y Distribución para que siga profundizando en el tema. Ya que el establecimiento de límites de excursión de la TCM para el almacenamiento y transporte de medicamentos en zonas climáticas IVb será un recurso importante a nivel mundial, el objetivo del artículo de Estímulo es delinear el razonamiento para actualizar el capítulo ?1079.2? para abordar la TCM para la zona climática IVb y proponer límites de excursiones.
CADENA DE SUMINISTRO FARMACÉUTICO Y RIESGO DE LAS EXCURSIONES DE TEMPERATURA
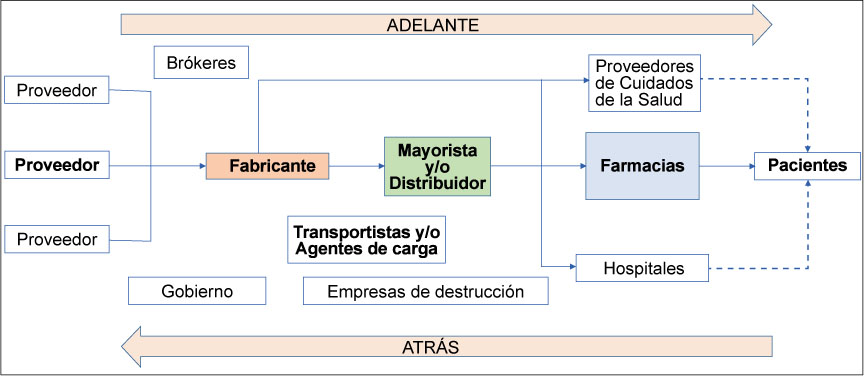
Debe adoptarse una visión holística de la cadena de suministro farmacéutico para determinar los riesgos relacionados con las excursiones de temperatura, incluyendo factores como (Figura 1):
- La complejidad de la cadena de suministro con múltiples participantes.
- Dos actividades clave que todos los participantes de la cadena de suministro tienen en común son los siguientes: el almacenamiento y el transporte.
- El uso de distintos medios de transporte que permiten el movimiento del producto a lo largo de la cadena de suministro, desde el fabricante hasta el cliente.
- Las cadenas de suministro a nivel mundial pueden estar sujetas a distintas reglamentaciones locales y zonas climáticas que actúan como factores generadores de complicaciones.
- Todos los participantes de la cadena de suministro tienen una responsabilidad conjunta.
Figura 1. Cadena de suministro farmacéutico.
Para mantener la calidad original del producto, todos los participantes involucrados en el almacenamiento y transporte de un producto terminado deben conocer en profundidad los riesgos durante su transporte y almacenamiento, además de contar con estrategias de mitigación apropiadas para controlar tales riesgos.
Las organizaciones deberían dedicar esfuerzo y recursos para el transporte, manejo y almacenamiento de medicamentos de tal manera que se reduzca el riesgo a la exposición de temperaturas fuera de las condiciones de almacenamiento declaradas en el etiquetado, también conocidas como excursiones de temperatura. Aunque debe hacerse todo el esfuerzo posible para mantener a los medicamentos dentro del intervalo de temperaturas indicado en el envase, pueden ocurrir excursiones de temperatura. En la zona climática IVb, aquellos medicamentos en los que se realizaron estudios de estabilidad para proporcionar condiciones de almacenamiento de 15° a 30° a menudo se transportan en vehículos sin control de temperatura y durante su recorrido pueden someterse a distintas temperaturas extremas o ser almacenadas en instalaciones de almacenamiento en tránsito que no cuentan con un control termostático. Incluso dentro de las cámaras de estabilidad, donde se han realizado estudios de estabilidad para medicamentos con variación de temperatura y humedad relativa, pueden ocurrir excursiones de temperatura. Un hallazgo frecuente en las auditorías es la falta de atención a las excursiones en la cámara de estabilidad, como se evidencia en una muestra de las Cartas de Advertencia enviadas por la Administración de Alimentos y Medicamentos de los Estados Unidos. (FDA), citado por Huynh-Ba y Latoz (2021).
Las excursiones de temperatura son un riesgo en la cadena de suministro farmacéutico actual, y cuando se observan deben ser evaluadas, reducidas y comunicadas. El efecto de una excursión puede resultar en una pérdida de ensayo, aumento de impurezas, precipitación del medicamento, cambio en el patrón de disolución, cambios de fase, etc. (Nirmal y Ajeya, 2017). Estos efectos dependen de la estabilidad del producto, así como de la temperatura y la duración de la excursión.
Sin una evaluación de riesgo, las excursiones de temperatura a menudo resultan en pérdidas considerables para los programas de salud pública que operan en países con recursos limitados. Para evaluar el impacto de una excursión de temperatura, es preferible consultar al fabricante. Sin embargo, esto puede plantear un desafío dependiendo de la disponibilidad de datos y la capacidad de respuesta del fabricante del medicamento (Jenkins y colaboradores, 2022). Entonces, la TCM puede ser una herramienta útil cuando el participante subsiguiente de la cadena de suministro no cuenta con los datos de estabilidad.
El capítulo ?1079.2? define a la TCM como la temperatura única calculada, a la cual la cantidad total de degradación durante un periodo determinado es igual a la suma de las degradaciones individuales que ocurrirían a diferentes temperaturas. Es una manera de resumir el historial del tiempo de la exposición de un producto mediante una sola temperatura “efectiva” o “virtual”. Por ende, la TCM integra el historial de la temperatura en función del tiempo al asumir premisas acerca de la cinética de la degradación química de un producto.
Básicamente, la ecuación de Arrhenius demuestra que la velocidad de reacción aumentará exponencialmente con la temperatura, en lugar de hacerlo de forma lineal. Correspondientemente, es importante entender la TCM, ya que proporciona la temperatura efectiva de la isoterma experimentada por el producto, que toma en cuenta el efecto de las excursiones de temperatura basadas en Arrhenius durante su almacenamiento (Jenkins y colaboradores, 2022).
Aunque la TCM es una herramienta valiosa para ayudar a acceder a la excursión de temperatura, puede no ser apropiada en algunas situaciones. Por ejemplo, en casos en donde un producto está sujeto a cambios de fase (supositorios, líquidos, suspensiones, emulsiones, cremas, etc.) y/o cuando los datos de estudios clínicos indican que las excursiones de temperatura pueden impactar a la calidad y seguridad del producto. Health Canada (2020) también ha señalado a los productos biológicos como una categoría para los que la TCM puede no ser adecuada. Si no se puede usar la TCM, se pueden usar estudios de estabilidad y estrés y estudios de ciclos de congelación y descongelación y temperaturas elevadas para analizar el riesgo y justificar el proceso de toma de decisiones para vender o desechar el producto. Por ende, cuando la TCM no es apropiada para evaluar una excursión de temperatura, se lo deberá comunicar a los participantes de la cadena de suministro.
No debe abusarse del uso de la TCM para evaluar una excursión de temperatura. La TCM sola no es suficiente para evaluar el impacto de una excursión de temperatura, y es necesario que también se conozca lo siguiente:
- ¿Cuánto duró la excursión de temperatura?
- ¿Cuáles fueron las temperaturas de la excursión?
- ¿Hubo excursiones de temperatura superiores a 40°?
- ¿Qué periodo de tiempo se utilizó para calcular la TCM?
SUGERENCIAS PARA LOS LÍMITES DE EXCURSIÓN PERMITIDOS PARA LA TEMPERATURA AMBIENTE NO CONTROLADA EN LAS ZONAS CLIMÁTICAS IVb POR ANALOGÍA A LA TEMPERATURA AMBIENTE CONTROLADA
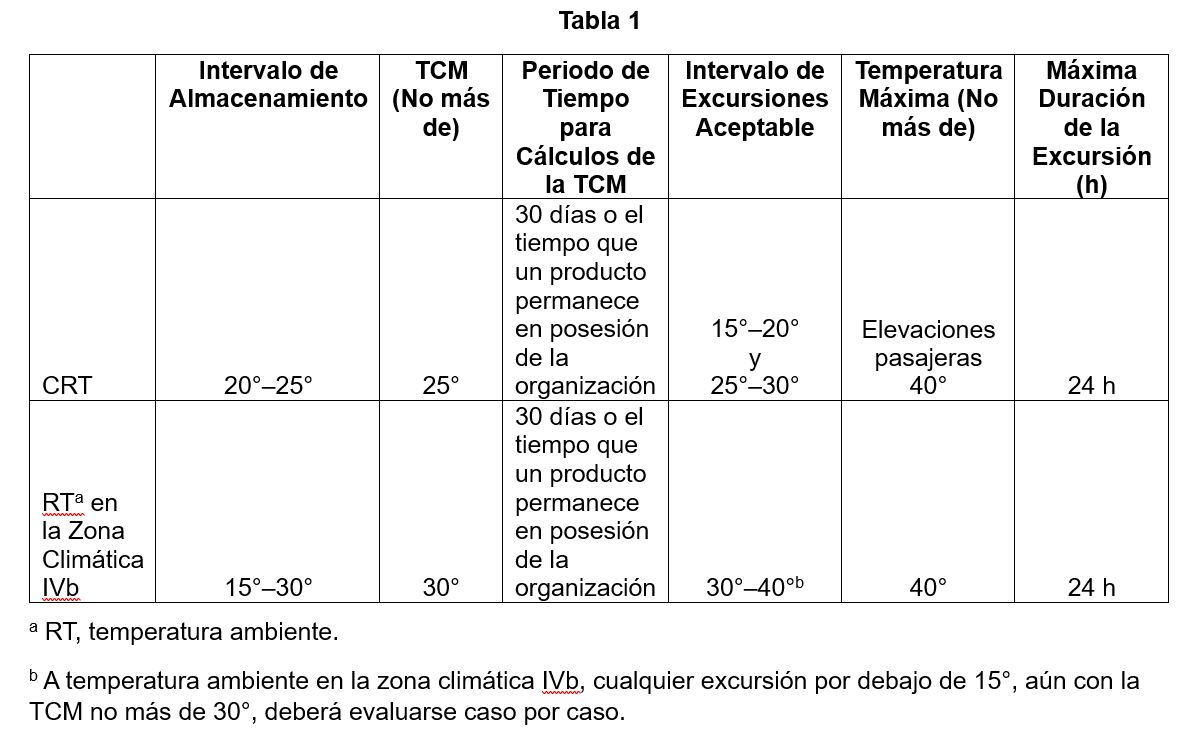
La justificación y el fundamento para los posibles límites de excursión para las zonas climáticas IVb se basaron en los límites de excursión vigentes para la CRT. En la Tabla 1 se muestran los límites vigentes para la CRT y los límites sugeridos para el almacenamiento desde 15° a 30° (Temperatura Ambiente, RT, por sus siglas en inglés, en la zona climática IVb).
El límite de la TCM para la temperatura ambiente en la zona climática IVb no debe ser más de 30°, ya que es la isoterma donde se estableció la estabilidad a largo plazo para esta condición.
El periodo de tiempo usado para calcular la TCM debe ser de 30 días o el tiempo en el que el producto permanece en posesión de la organización, como se establece en el capítulo ?1079.2?. Dado que la TCM es un cálculo, el uso de un periodo de tiempo prolongado podría provocar un sesgo en dicho cálculo al incluir la mayoría de los datos de temperatura fuera de la excursión, y por ende presentar una imagen inexacta de la TCM y por consiguiente, del impacto real de la excursión.
La temperatura máxima de excursión no deberá ser de más de 40°, ya que 40° es la condición de estabilidad acelerada estándar del Consejo Internacional de Armonización (ICH, por sus siglas en inglés) para medicamentos a temperatura ambiente. Pueden aceptarse excursiones de temperatura más allá de los 40°, si se cuenta con datos de estabilidad satisfactorios. Las temperaturas mayores de 40° aumentan la posibilidad de la degradación del producto. Asimismo, se ha demostrado el impacto adverso de las temperaturas de excursión bajas, que pueden provocar la pérdida del efecto terapéutico o reducir la calidad del producto. Algunos de los ejemplos relacionados con los efectos adversos de las excursiones de temperaturas bajas en algunos productos son los siguientes: la precipitación del medicamento o la dislocación de las posiciones de la red cristalina (Nirmal y Ajeya, 2017). Por este motivo, también debe evaluarse el impacto de las excursiones de temperatura por debajo de los 15°, ya que los estudios clásicos de estabilidad no someten a los productos a la exposición a bajas temperaturas al desarrollar los requisitos de almacenamiento del producto a los 15°–30°. Las temperaturas entre 2° y 15° presentan un riesgo de precipitación solo para soluciones muy concentradas. Para todos los demás medicamentos, tales temperaturas solo retrasan el proceso de degradación.
Se asume que una excursión de 24 horas dentro del intervalo de excursiones aceptable debería causar un impacto insignificante en el producto. Sin embargo, como ya se mencionó anteriormente, existen algunos productos que pudieran tener una tolerancia más estrecha a las excursiones de temperatura y en ese caso no debe usarse la TCM para evaluar una excursión. La idea del intervalo de excursiones de 24 horas está apoyada por lo siguiente:
- El ICH (2003) estableció que las excursiones en instalaciones de almacenamiento para los estudios formales de estabilidad, que exceden las tolerancias definidas por más de 24 horas, deben describirse en el informe del estudio, además de evaluar su efecto.
- El estudio de Jenkins y colaboradores. (2022) demostró una pérdida de la vida útil de 2 semanas para una forma farmacéutica sólida que originalmente tenía 24 meses de vida útil. La temperatura de almacenamiento máxima del producto fue de 30° y con una excursión de temperatura de 6 días a 40°, el impacto fue mínimo.
Los profesionales de calidad deberán evaluar periódicamente la frecuencia de las excursiones de temperatura. Para los casos en que se observen de manera recurrente excursiones provenientes de instalaciones específicas o del recorrido, deberá tomarse una decisión (Nirmal y Ajeya, 2017) y establecerse tanto una acción correctiva como una acción preventiva (CAPA, por sus siglas en inglés) para determinar el proceso y las medidas que deben adoptarse, si las hubiera. Un problema común que debe ser descartado es la omisión por parte del personal de apagar los dispositivos que monitorean la temperatura una vez que el producto ha sido almacenado y el dispositivo ha sido retirado.
En este momento es especialmente importante establecer límites de excursiones de temperatura para la zona climática IVb, no solo para evaluar el impacto de una excursión en el producto durante su distribución, sino también para establecer un criterio de aceptación para los estudios de caracterización del perfil de la temperatura del recorrido (mapeo de la temperatura de los recorridos) para seleccionar los recorridos y luego desarrollar las calificaciones necesarias.
CONCLUSIÓN
El almacenamiento, manejo y transporte de un medicamento debe mantenerse bajo las condiciones de almacenamiento recomendadas para mantener su calidad, seguridad y eficacia.
La TCM no puede usarse para normalizar situaciones de condiciones de almacenamiento que se encuentren fuera de control, aunque puede ser una herramienta útil para evaluar una excursión de temperatura. Por lo tanto, el uso de la TCM al evaluar una excursión de corta duración (como se define en el capítulo ?1079.2?) y el periodo de tiempo usado para calcular la TCM, según la recomendación de la USP, puede facilitar la gestión responsable del riesgo de excursión.
Los límites de excursiones de temperatura para la zona climática IVb en este artículo, que fueron sugeridos para actualizar el capítulo ?1079.2?, pueden ayudar a las partes interesadas de la cadena de suministro en el proceso de toma de decisiones para conservar o desechar un producto luego de una excursión. Los productos de los programas de salud pública que operan en países con recursos limitados no se desecharán debido a la falta de una norma que ayude a evaluar el riesgo y el impacto de una excursión de temperatura. Por ende, aquellos límites permitirán que cuando se realicen estudios de perfiles de temperatura de los recorridos, las partes interesadas puedan decidir para que recorridos el producto debe tener una protección pasiva o activa calificada. Por ende, estos límites también pueden aplicarse a los productos distribuidos en las zonas climáticas III y IVa, si los productos fueron sometidos a pruebas de estabilidad a largo plazo a 30° y se almacenan a una temperatura ambiente de 15°–30°.
FUENTES ADICIONALES DE INFORMACIÓN
- Anderson C, Seevers R, Hunt D. The use of mean kinetic temperature to aid evaluation of temperature excursions: proper and improper application. En: Pharm Forum. 2018;44(4).
- Anderson C, Seevers R, Hunt D. The use of mean kinetic temperature to aid evaluation of temperature excursions for controlled cold temperature drugs: proper and improper application. Pharm. Forum. 2019.
- Jenkins D, Cancel A, Layloff T. Mean kinetic temperature evaluations through simulated temperature excursions and risk assessment with oral dosage usage for health programs. BMC Public Health. 2022;22(1):300. doi: 10.1186/s12889-022-12660-9.
- Health Canada. Guidelines for environmental control of drugs during storage and transportation. GUI-0069. 2020.
- Huynh-Ba K, Latoz C. How to investigate temperature and humidity excursions of stability chambers. Am. Pharm. Rev. 2021.
- International Conference of Harmonisation of Technical Requirements for Registration of Pharmaceuticals For Human Use. ICH harmonised tripartite guideline. Stability testing of new drug substances and products Q1A(R2). 2003.
- Nirmal K, Ajeya J. Temperature excursion management: a novel approach of quality system in pharmaceutical industry. Saudi Pharm. J. 2017;25(2)176–183.
a Comité de Expertos de Envasado y Distribución de la USP
b QUALITASPHARMA
c Personal de la USP
d Cardinal Health
e Pearl Pathway
f Novo Nordisk
Información complementaria: Le pedimos que antes de comunicarse con la USP revise si su pregunta se encuentra en la sección de Preguntas Frecuentes
Tema/Pregunta
Contacto
Comité de Expertos
EL USO DE LA TEMPERATURA CINÉTICA MEDIA Y LA NECESIDAD DE LÍMITES DE EXCURSIONES PERMITIDOS PARA LA ZONA CLIMÁTICA IVb
Desmond G. Hunt
Científico Principal Sénior
GCPD2020 Capítulos Generales – Envasado y Distribución
Información de la página:
No Aplica
DocID: GUID-1B0F4294-DED1-4F7A-A88D-9B101302D1EF_10101_en-US
.